باتری های سرب اسید را بیشتر بشناسیم (SLA (Sealed Lead Acid Battery
 ۲۸ اسفند ۱۳۹۶
۲۸ اسفند ۱۳۹۶
قیمت نسبتا پایین این نوع از باتریها در مقایسه با سایر باتریهای مشابه و همچنین قابلیت جریان دهی لحظهای بالای آنها، باتریهای سرب اسیدی را تبدیل به بهترین انتخاب برای مصارف گونان همچون خودروها، کشتیها و بویژه یوپی اس ها نموده است. البته در کنار این حسن میبایست به نقطه ضعف اصلی باتری سرب اسید نیز اشاره نمود:
این یک قانون کلی برای هر نوع باتری است که در هر دشارژ کامل، اندکی از ظرفیت باتری از دست میرود. البته این مقدار تا هنگامی اندک خواهد بود که باتری در شرایط خوب و ابتدای عمر خود باشد با افزایش عمر باتری و افزوده شدن سیکل های دشارژ، بتدریج مقدار ظرفیت از دست رفته در هر سیکل دشارژ بیشتر خواهد شد. البته لازم به ذکر است که این پدیده در تمام انواع باتری ها دیده میشود ولی درجات آن متفاوت است. بطور کلی حساسیت نسبی باتریهای سرب اسید به دشارژ کامل باعث شده است که حداکثر تعداد سیکلهای دشارژ کامل یا اصطلاحا “Deep Discharged” آنها حدودا بین ۲۰۰ تا ۳۰۰ سیکل باشد. دشارژ عمیق باتری باعث بروز پدیدهای به نام “خوردگی شبکه” یا Grid Corrosion، در صفحات قطب مثبت باتری میشود که شدیدا در کاهش طول عمر باتری تاثیرگذار است.
باتری های سرب اسید و نیکل کادمیوم را اگر به حال خود رها کنند، بدلیل وجود پدیده خود دشارژی (Self Discharge)، بتدریج دشارژ خواهند شد. اما سرعت این پدیده در باتری های نیکل کادمیم حدودا چهار بار بیشتر از باتریهای سرب اسیدی است. احتمالا شنیدهاید که زمان انبارداری باتری های سرب اسیدی نباید بیش از ۶ ماه باشد، علت آن همین پدیده خود دشارژی است. چون پس از گذشت چند ماه باتری به طور کامل دشارژ شده و همانطور که گفتیم دشارژ عمیق باتری باعث آسیب دیدن آن و بروز پدیده خوردگی شبکه باتری میشود. در انتهای مطلب گذر مجددی به دلیل بروز این پدیده خواهیم داشت.
شارژ باتریهای سرب-اسیدی ساده است و حتی به کمک یک منبع ولتاژ نسبتا ساده (مثل دینام خودرو) نیز میتوان براحتی باتری را شارژ نمود. اما حتما میبایست محدودیتهایی را در سطح ولتاژ شارژر در نظر گرفت. یکی دیگر از دلایل بروز پدیده خوردگی شبکه قطب مثبت باتری بالا بودن ولتاژ شارژر باتری است. وجود مستمر ولتاژ بیش از ۱۳٫۷ ولت بر هر باتری (یا ولتاژ ۲٫۲۸ برای هر سلول باتری)، احتمال بروز پدیده خوردگی قطب مثبت را افزایش میدهد، اما اگر برای جلوگیری از وقوع آن ولتاژ شارژر را بیش از حد کاهش دهیم حال پدیده مخرب دیگری بنام سولفاته شدن قطب منفی (Sulfation) رخ خواهد داد که بازهم منجر به کاهش ظرفیت توان دهی باتری میشود. لذا در صورتیکه تمایل به استفاده مناسب ازباتریهای سرب اسیدی وجود داشته باشد میبایست حتما از یک شارژر مناسب با در نظر گرفتن کلیه محدودیتهای این نوع باتریها استفاده نمود.
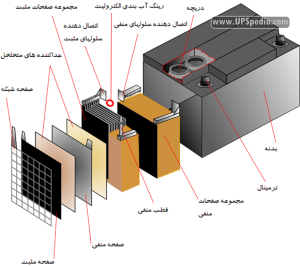
الکترود یا صفحات مثبت که به آنها آند نیز گفته میشود. الکترونها در حین دشارژ جذب این قطب یا صفحات میشوند. در باتری های سرب اسیدی ماده شیمیایی عمده تشکیل دهنده صفحات مثبت، اکسید سرب (PbO2) میباشد.
الکترود یا صفحات منفی که به آنها کاتد نیز گفته میشود. الکترونها در حین دشارژ از این قطب خارج میشوند. ماده شیمیایی عمده تشکیل دهنده اکترودهای منفی، سرب (Pb) است. لازم بذکر است که سرب یا اکسید آن از لحاظ مکانیکی قابلیت فرم گیری مناسب ندارند و اغلب به کمک افزودن آلیاژهای مختلف و همچنین شبکههای نگهدارنده حالت دهی میشوند. ضمنا اصطلاحا آنها را مواد فعال یا Active Material نیز میگویند زیرا در اصل واکنش شیمیایی داخل باتری به کمک سرب و اکسید آن صورت میگیرد.
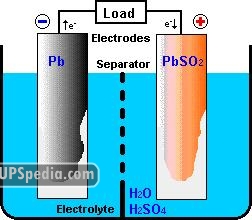
شکل ۲: نمای ساده شدهی درون یک باتری
الکترولیت که محیط ما بین دو الکترود را پر میکند و در واقع بستری برای عبور شارژ بین الکترودهای مثبت و منفی را فراهم میآورد. در باتری های سرب اسیدی هر دو قطب در محلولی از اسید سولفوریک (H2SO4) با غلظتی در حدود ۲۵ تا ۴۰ درصد و آب (H2O) با غلظتی در حدود ۶۰ تا ۷۵ درصد، غوطه ور هستند. ترکیب آب و اسید سولفوریک باعث میشود که اسید سولفوریک بصورت یونیزه درآمده و به یونهای H+ و HSO4– تبدیل شود.
جداکننده و فاصله دهنده، بخش دیگر باتری های سرب اسیدی را تشکیل میدهند. وظیفه اصلی آنها جدا سازی و ایزوله کردن الکتریکی قطبهای مثبت و منفی از یکدیگر است. بخشی از تکنولوژی ساخت باتری های سرب اسیدی مربوط به طراحی این ایزولاتورهای الکترومکانیکی است. در بعضی از انواع که از نظر حجم باتری محدودیتی وجود ندارد این ایزولاسیون به کمک ایجاد فاصله فیزیکی بین الکترودها ایجاد میشود که باعث ارزانتر شدن باتری ولی افزایش حجم آن میشود. انواع مختلفی از جدا کنندهها تا بحال ابداع شدهاند که مرسوم ترین آنها عبارتند از:
الف) جداکنندههای PVC که اغلب ترکیبی از آلیاژ سرب و آنتیموان میباشند و از نظر هدایت الکتریکی ضعیفترین پاسخ را دارند.
ب) جداکنندههای سلولزی که از هدایت الکتریکی نسبی و تخلخل مناسبی برخوردار میباشند.
ج) جداکنندههای پلی اتیلنی، از استحکام مکانیکی و هدایت مناسبی برخوردار هستند و بدلیل فرم پذیری مناسب خود اغلب بصورت پاکتی الکترودهای مثبت را در بر میگیرند.
د) جدا کنندههای AGM (Absorptive Glass Mat) تقریبا به عنوان بهترین نوع جدا کننده شناخته میشوند و تاثیر بسزایی در برگشت پذیری مجدد اکسیژن آزاد شده در واکنشها به محیط شیمیایی باتری ها بازی میکنند.
ه) جدا کنندههای Gel تقریبا مشابه AGM میباشند و بطور کلی در باتریهایی که از این نوع جدا کنندهها استفاده میکند الکترولیت بصورت مایع جریان ندارد و اغلب بصورت ژلی یا خمیری شکل است.
بطور کلی اختلاف ولتاژ ایجاد شده به کمک یک سلول از الکترودهای مثبت و منفی در باتری های سرب اسیدی حدود ۲ تا ۲٫۱ ولت است. لذا ولتاژهای بالاتر مثل ۱۲ ولت از اتصال سری چندین سری از الکترودهای مثبت و منفی تشکیل میشود. قطر صفحات مثبت و منفی نقش اساسی در تعیین ظرفیت باتری بازی میکنند. اغلب برای کاربردهای با ظرفیت معمول همچون باتریهای استارتر خودرو قطر این صفحات کمتر از ۲ میلی متر است. اما در کاربردهایی با قابلیت شارژ دهی طولانی قطر الکترودها به ۶ میلی متر نیز خواهد رسید.
حال که با کلیت یک باتری سرب اسید آشنا شدهاید اجازه دهید که اندکی نیز به روابط شیمیایی داخل باتری و نحوه ایجاد جریان و روند شارژ بپردازیم.
روند دشارژ
در روند دشارژ، الکترود مثبت الکترون را از مدار بیرونی به خود جذب میکند. این الکترونها با مواد فعال قطب مثبت و یونهای موجود در الکترولیت، یک واکنش شیمیایی را آغاز میکنند. این واکنش در رابطه زیر نمایش داده شده است: PbO2 + HSO4– + ۳H+ + ۲e– → PbSO4 + ۲H2O
همانطور که دیده میشود الکترون دریافت شده از مدار بیرونی و یونهای موجود در الکترولیت اطراف الکترود مثبت باعث تولید سولفات سرب (PbSO4) و آب در اطراف آن میشوند. لازم بذکر است که اکسید سرب (PbO2) که ماده فعال قطب مثبت محسوب میشود بتدریج به سولفات سرب تبدیل میشود، که در نهایت کل سطح قطب مثبت را فرا خواهد گرفت و در آن هنگام دیگر باتری جریان نمیدهد. ضمنا در طی این واکنش خاصیت اسیدی محلول الکترولیت به تدریج از بین میرود و آب جای آن را میگیرد. تبدیل اسید به آب یکی از ویژگیهای جالب باتری های سرب اسیدی است. همانطور که گفتیم هر چه باتری دشارژ میشود اسید باتری مصرف شده و آب جای آن را میگیرد پس میتوان براحتی با اندازه گیری اسیدیته محلول الکترولیت باتری میتوان پی به سطح شارژ آن برد. همانطور که شاید دیده باشید بعضی از باتریهای ماشین دارای یک نمایشگر سطح شارژ هستند که در واقع شبیه یک کاغذ تورنسل، سطح اسیدیته را با رنگهای مختلف نشان میدهد. یا خیلی از باتری سازها وسیلهای شبیه به یک قطره چکان برای اندازهگیری کیفیت باتری های “تر” دارند.
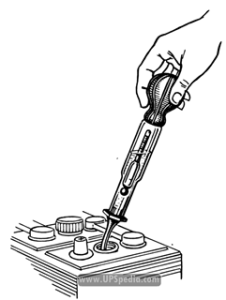
شکل ۳: اندازه گیری اسیدیته باتری های تر
اما در همین هنگام در مجاورت قطب منفی واکنش دیگری در حال اتفاق است. سرب موجود در قطب منفی با یون های HSO4– وارد واکنش میشود و نتیجه آن تولید سولفات سرب و الکترون آزاد است.
Pb + HSO4– → PbSO4 + H+ + 2e–
این واکنش را اکسداسیون سرب نیز مینامند.
البته به نکته دقت داشته باشید که مدار بار و باتری از نظر الکتریکی بسته محسوب میشوند و هر الکترون تولید شده در قطب منفی پس از عبور از بار به قطب مثبت وارد شده و هر دو واکنش فوق را کاملا امکان پذیرمیسازد. مطابق این واکنشها، در انتهای پروسه دشارژ سطح هر دو قطب بطور کامل با سولفات سرب (PbSO4) پوشیده خواهد شد و محیط اسیدی الکترولیت، خاصیت اسیدی خود را از دست میدهد.
مولکولهای سولفات سرب علاقه زیادی به تشکیل کریستالهای بزرگ و سخت دارند که پس از تشکیل، بدلیل بزرگی دیگر تمایلی به بازگشت پذیری ندارند و در واکنشهای شارژ شرکت نمیکنند. به همین دلیل اغلب توصیه میشود که باتری های سرب اسیدی در حالت دشارژ نگهداشته نشوند. این نکته دلیل همان توصیهایست که اسرار دارد، زمان انبارداری باتری های سلید اسیدی نباید بیشتر از ۶ ماه باشد. دلیل آن اینست که محلول الکترولیت باتری و الکترودهای مثبت و منفی حتی در زمانی که باتری به مدار بیرونی متصل نیستند، میتوانند واکنشهای بالا را درون محیط باتری البته با سرعت کمتری انجام دهند و در نتیجه پس از گذشت مدت زمانی، باتری دشارژ شده و سولفات سرب سطح قطبها را پر میکند (همانطور که گفته شد به این پدیده خود دشارژی یا Self Discharge میگویند). حال اگر باتری ها مجددا شارژ نشوند، سولفات سرب تبدیل به کریستالهایی خواهد شد که دیگر در واکنشهای شیمیایی شرکت نمیکند وباتری از بین خواهد رفت. در شکل زیر در سمت چپ (شکل a) کریستالهای سولفات سرب دیده میشود که از یک دشارژ مناسب ایجاد میشوند، در صورتیکه شکل سمت چپ (شکل b) کریستالهای بزرگ سولفات سرب را نشان میدهد که بدلیل بزرگی تمایلی به شرکت مجدد در واکنشهای شیمیایی باتری ندارند. مهمترین عامل تشکیل اینگونه سولفاتها روند نامناسب دشارژ و اغلب دشارژهایی تا ولتاژ پایین و عدم شارژ مناسب باتری است. گرچه دشارژ با جریانهایی با پیک بالا نیز ممکن است منتج به این پدیده شود.

شکل ۴: نمای میکروسکوپیک سطح قطبهای یک باتری سرب اسیدی
a) کریستالهای سولفات سرب معمولی b) کریستالهای سولفات سرب ناشی از دشارژ نامناسب
این روند کاملا عکس روند دشارژ است، در قطب مثبت از ترکیب آب و سولفات سرب، اکسید سرب و یونهای هیدروژن متصاعد میشود.
PbSO4 + 2H2O → PbO2 + HSO4– + 3H+ + 2e–
در قطب منفی یونهای هیدروژن تولید شده از رابطه فوق به همراه سولفات سرب وارد واکنش شده و مجددا سرب و یون HSO4– تولید میکنند.
PbSO4 + H+ + 2e– → Pb + HSO4–
همانطور که دیده میشود روابط شارژ و دشارژ کاملا عکس یکدیگر بوده و در نتیجه اولا به باتری قابلیت شارژ و دشارژ مداوم را میدهند در ثانی از الکترون تولید شده در واکنشها جهت ایجاد جریان مورد نیاز در مصرف کنندهها استفاده میشود.
در جدول ذیل خلاصهای از روابط شیمیایی رخ داده در قطب ها مثبت و منفی در هنگام شارژ و دشارژ آورده شده است.
البته در کنار این دو واکنش پدیده دیگری نیز در فاز شارژ رخ میدهد که در نتیجه منجر به تولید گاز هیدروژن در اطراف قطب منفی و گاز اکسیژن در مجاورت قطب مثبت میشود که بدلیل اهمیت زیاد این مطلب به طور گذرا به دلایل بروز آن اشاره میکنیم. این گازها برخلاف یونها، فرار بوده و با خارج شدن از محیط باتری باعث کم شدن آب باتری خواهد شد. اما علاوه برآن اگر چگالی آنها در محیط افزایش یابد این گازها قابلیت انفجار دارند. شاید شنیده باشید که فضای باتری خانهها باید از تهویه مناسبی برخوردار باشند. این پدیده یکی از دلایل لزوم وجود تهویه مناسب است. تنظیم ولتاژ شارژر و بالا نبودن آن تاثیر بسزایی در کنترل این پدیده خواهد داشت. افزایش این گازها، در صورتیکه باتری از نوع آب بندی شده (Sealed Lead Acid) باشد، فشار داخلی باتری را افزایش دهد. در این مقاله فرصت بررسی کامل این پدیده وجود ندارد اما مهمترین عامل آن یونیزه شدن آب به کمک جریان شارژ میباشد. همانطور که گفته شد باتری در حالت دشارژ شده سرشار از آب است، برای شارژ آن نیز نیاز به اعمال ولتاژ بیرونی به دو قطب است. همواره بخشی از مولکولهای آب بدلیل وجود این ولتاژ یونیزه شده و گازهای هیدروژن و اکسیژن تولید میکنند.
پدیده یونیزاسیون آب: ۲H2O → ۲H2+O2
در کنار قطب مثبت صفحه شبکه دیده میشود که دو وظیفه اصلی را برعهده دارد ۱) استحکام بخشی مکانیکی بیشتر به قطب، چرا که بطور کلی سرب از استحکام مکانیکی مناسبی برخوردار نیست ۲) کمک به ایجاد مسیری برای عبور بهتر جریان الکترونها که ترمینالها
دریچههای نشان داده شده در شکل نیز وظیفه حفاظتی را بر عهده دارند. در مقاله دیگر به طور کامل تفاوت باتری های آب بندی شده (Sealed)را با سایر انواع باتری شرح میدهیم ولی در اینجا صرفا به این نکته اشاره میکنیم که در صورتیکه روند شارژ به صورت مناسب انجام نشود احتمال تولید گازهای هیدروژن و اکسیژن در محیط باتری وجود دارد. در باتریهای آب بندی شده، ارتباط محیط داخل باتری با بیرون آن برای جلوگیری از فرار این گازها مسدود شده است؛ اما برای جلوگیری از بالا رفتن بیش از حد فشار داخلی باتری دریچههای حفاظتی تعبیه شده است تا در صورت بروز خطر، گازهای هیدروژن یا اکسیژن را به بیرون فضای باتری انتقال دهند.

























































.png)